このページでは、化学反応式の書き方の手順を中学生に向けて説明するよ!
また、このページは【化学反応式の書き方解説】の6ページ目だよ。
化学反応式の書き方を1から学習したい人は1ページ目から読んでみてね!
それでは化学反応式の書き方の学習スタート☆
化学反応式の書き方
さてみんな、前のページまでを読んで「係数」の意味はしっかり理解できているかな?
いよいよ化学反応式の書き方の学習だよ。がんばろうね!
化学反応式は、次の①~③の手順で書けば絶対にうまく書くことができるよ。
- 書き方① 反応式を日本語で書く
- 書き方② 日本語の部分を「化学式」に変える
- 書き方③ モデルを書いて原子の個数をそろえる
それでは①から説明を始めていくね!
書き方① 反応式を日本語で書く
まず、書きたい化学反応式を「日本語」で書くようにしよう。
反応前の物質を矢印の左に、反応後の物質を矢印の右に書くよ!
例題で確認しながらやってみよう!
数学と違って、反応前と反応後の式は「=」ではなく「→」でつなぐよ!
例題① 炭素と酸素がくっついて、二酸化炭素になる化学反応式を書け。
「炭素」と「酸素」が合わさって「二酸化炭素」になるんだね。だから、
炭素 + 酸素 → 二酸化炭素
これでOK!
例題② 水を電気分解して、水素と酸素に分かれる化学反応式を書け。
「水」が「水素」と「酸素」に分かれるんだね。だから
水 → 水素 + 酸素
これでOK!
例題③ 酸化銀を加熱して、銀と酸素に分かれる化学反応式を書け。
「酸化銀」が「銀」と「酸素」に分かれるんだね。だから
酸化銀 → 銀 + 酸素
これでOK!
これで「書き方①反応式を日本語として書く」は完成!
慣れれば、この書き方①はやらなくてもいいんだけど、初めのうちは必ずやろうね。
それでは、書き方②に進むよ。
書き方② 日本語の部分を「化学式」に変える
それでは例題の続きをするよ。
例題① 炭素と酸素がくっついて、二酸化炭素になる化学反応式を書け。
炭素 + 酸素 → 二酸化炭素
ここまでは書き方①でやったんだよね。
では、「書き方②日本語の部分を「化学式」に変える」をやってみよう!
日本語: 炭素 + 酸素 → 二酸化炭素
の日本語部分を化学式に変えるよ。
炭素の化学式は「C」
酸素は「O2」
二酸化炭素は「CO2」
つまり
化学式になおす: C + O2 → CO2
だね。
(化学式をおぼえないと「書き方②」ができないから、化学反応式は絶対書けるようにならないよ。)
これで「書き方②」はOKだよ!
 ねこ吉
ねこ吉ねえ先生。日本語の「酸素」を化学式に変えるとき、
「O」か「O2」か、迷うんだよね…。
いい質問だね。
結論から言うと、酸素は絶対に「O2」と書かなければいけないよ!
ただ、その理由は話すと少し長くなってしまうんだ…。
「理由はいいから、とにかく書ければいい!」という人は、さっきの
練習して、「とにかく練習問題と同じ化学式に直せばよい」とおぼえていいよ。
ただ、できれば理由もわかったほうがいいから、説明しておくね。
話は「分子」のところに戻るんだけど、
①. 酸素原子→![]()
![]()
1つで空気中をとびまわることは無い。
吸っても呼吸の役に立たない。
ものを燃やすのを助けない。
②. 酸素分子→![]()
![]()
空気中ではいつもこのように酸素原子2つがくっついて飛び回り、「酸素分子」となっている。
呼吸に必要。
ものが燃えるを助ける。
③. オゾン分子→![]()
![]()
毒。 くさい。
という感じだったよね。
さて、
例題① 「炭素と酸素がくっついて、二酸化炭素になる化学反応式を書け。」
の「酸素」は①~③のどれだと思う?



③. の酸素分子酸素分子か。
そう、化学反応式で「酸素」と出てきたら「酸素原子![]()
![]()
![]()
![]()
これはいつも必ず、絶対に「酸素分子のこと」なんだ。
だから化学反応式のときは、「O2」と書かなければいけないんだね。
(同じように水素は「H2」。窒素は「N2」。)
わかったかな?
長くなったけど、これで書き方②の例題①を終わるよ。
それでは例題で書き方②「日本語の部分を化学式に変える」の続きをするよ。
例題② 水を電気分解して、水素と酸素に分かれる化学反応式を書け。
水 → 水素 + 酸素
ここまで書き方①でやったんだよね。
では、「書き方②日本語の部分を「化学式」に変える」をやってみよう!
日本語: 水 → 水素 + 酸素
の日本語部分を化学式に変えるよ。
水の化学式は「H2O」
水素は「H2」
酸素は「O2」
つまり
化学式になおす: H2O → H2 + O2
だね。
これでOKだよ☆
それでは例題③に進もう。
例題③ 酸化銀を加熱して、銀と酸素に分かれる化学反応式を書け。
酸化銀 → 銀 + 酸素
ここまで書き方①でやったんだよね。
では、「書き方②日本語の部分を「化学式」に変える」をやってみよう!
日本語: 酸化銀 → 銀 + 酸素
の日本語部分を化学式に変えるよ。
酸化銀の化学式は「Ag2O」
銀は「Ag」
酸素は「O2」
つまり
化学式になおす: Ag2O → Ag + O2
だね。
これでOKだよ☆
よし。残るは「書き方③ モデルを書いて原子の個数をそろえる」だけだね。ここは係数をつかうよ。



係数については、前のページで学習したよね。
自信あるぞ!
お、頼もしいね!係数は
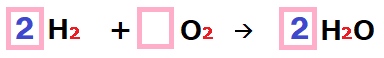
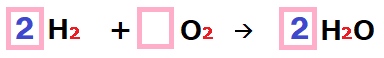
青い数字のことだよね。
あとはこの係数をつけることで、原子の個数をそろえることができるようになれば、化学反応式が完成だよ!
書き方③ モデルを書いて原子の個数をそろえる
例題① 炭素と酸素がくっついて、二酸化炭素になる化学反応式を書け。
書き方②で
C + O2 → CO2
ここまで完成しているね。
それでは②で書いた式の下にモデルを書いてみよう。
C + O2 → CO2
![]()
![]()
![]()
![]()
![]()
![]()
こんな感じだね。
モデルを書いたら、矢印の左側と右側で、原子の粒の数が同じかを確かめるんだ。
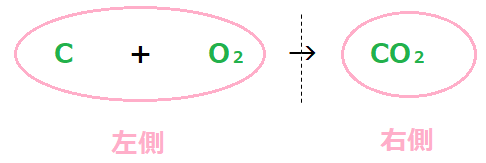
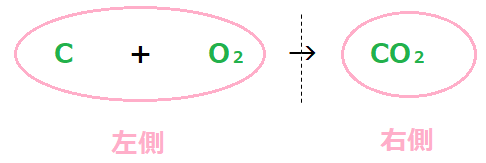
![]()
![]()
![]()
![]()
![]()
![]()
そうすると、
矢印の左側 … 炭素原子(![]()
![]()
![]()
![]()
矢印の右側 … 炭素原子(![]()
![]()
![]()
![]()
となり、矢印の左と右で原子の個数はそれぞれ同じだね。
矢印の左と右で原子の数が同じ場合は、書き方②でつくった
C + O2 → CO2
この式のままで化学反応式の完成となるよ。



係数は書かななくていいんだね。
例題① 炭素と酸素がくっついて、二酸化炭素になる化学反応式を書け。
答え C + O2 → CO2
次は例題②だね。
例題② 水を電気分解して、水素と酸素に分かれる化学反応式を書け。
書き方②で
H2O → H2 + O2
ここまで完成しているね。
②で書いた式の下にモデルを書いてみよう。
H2O → H2 + O2
![]()
![]()
![]()
![]()
![]()
![]()
こんな感じだね。
モデルを書いたら、矢印の左側と右側で、原子の粒の数が同じかを確かめるよ。
矢印の左側 … 水素原子(![]()
![]()
![]()
![]()
矢印の右側 … 水素原子(![]()
![]()
![]()
![]()
だよね。
例題①と違って、
矢印の左と右で原子(酸素原子)の個数があっていないね。
原子の個数があっていない場合、
H2O → H2 + O2
という化学反応式のままでは間違いになるんだよ。



え?間違いなの!?
水が水素と酸素に分かれているのに。
間違いなんだ。矢印の左と右で、原子の個数がそろっていないと、
「 H2O → H2 + O2 」
の1つ増えた酸素原子はどこからきたの?
となってしまうからね。
それでは、係数をつけて、原子の個数を左右でそろえていくよ。
確認だけど、係数は化学式の前、


のピンクの四角の中にしか書いてはいけないよ。
絶対に赤の小さい数字を書いたり変えてはいけないよ。



前のページで先生が言ってた、
赤の数字を変えると別の物質
になってしまうから。だね。
そういうこと。それでは係数を書いて、左右の原子の個数をそろえよう。


・![]()
![]()
![]()
![]()
![]()
![]()
今、矢印の左側の酸素原子が、1個たりないね。
足りない所を増やしていけば、いつか必ずそろうよ。
それでは、左側の酸素原子を増やそう。
何度も言うけど、ピンクの四角に係数をつけて、
水分子ごと増やさなければいけないよ。


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
矢印の左側 … 水素原子(![]()
![]()
![]()
![]()
矢印の右側 … 水素原子(![]()
![]()
![]()
![]()
となって。ねらい通り、酸素原子の数が左右でそろったね☆



あれ?だけどこんどは、
水素原子の数がずれてしまったよ。
ほんとうだね。
でも矢印の左側の酸素を増やすには、これしか方法がないから、これでいいんだよ。
水素の数がずれてしまったら
またそろえればいいんだ。
足りない所を増やしていけば、いつか必ずそろうからね。


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
それでは水素も足りないところを増やしてそろえよう。
右側のH2の前に係数をつけて…。


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
矢印の左側 … 水素原子(![]()
![]()
![]()
![]()
矢印の右側 … 水素原子(![]()
![]()
![]()
![]()
となって、原子の数が左右でそろったね!だから


この化学反応式で完成だよ!
例題② 水を電気分解して、水素と酸素に分かれる化学反応式を書け。
答え 2H2O → 2H2 + O2
最後は例題③だね。
例題③ 酸化銀を加熱して、銀と酸素に分かれる化学反応式を書け。
書き方②で
Ag2O → Ag + O2
ここまで完成しているね。
②で書いた式の下にモデルを書いてみよう。
Ag2O → Ag + O2
![]()
![]()
![]()
![]()
![]()
![]()
こんな感じだね。
モデルを書いたら、矢印の左側と右側で、原子の粒の数が同じかを確かめるよ。
矢印の左側 … 銀原子(![]()
![]()
![]()
![]()
矢印の右側 … 銀原子(![]()
![]()
![]()
![]()
だよね。
例題②と同じように、矢印の左と右で原子(銀原子も酸素原子も)の個数があっていないね。
原子の個数があっていないから、
Ag2O → Ag + O2
という化学反応式のままでは間違いだね。
それでは正解になるように係数をつけて、
原子の個数を左右でそろえていくよ。
係数は化学式の前、
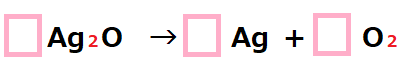
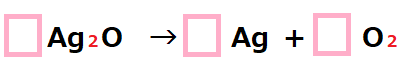
のピンクの四角の中にしか書いてはいけないね。
赤の小さい数字を書いたり変えたりしないでね。
それでは係数を書いて、左右の原子の個数をそろえよう。
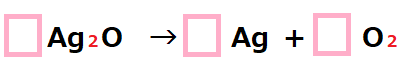
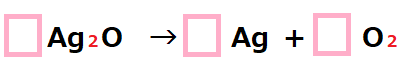
![]()
![]()
![]()
![]()
![]()
![]()
今矢印の左側の酸素原子が1個、
右側の銀原子が1個たりないね。
足りない所を増やしていけば、いつか必ずそろうんだよね。
酸素と銀、どっちから増やしてもいいけど、とりあえず銀原子から増やそうか。


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
これで左右の銀原子がそろったね!
あとは左側に酸素原子がたりないから増やしてみよう。
係数は化学式の前、ピンクの四角の前につけるんだよね。


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
→ +![]()
![]()
となり、矢印の左右で酸素原子の数がそろったね。



あれ先生、酸素はそろったけど、
さっきそろえた銀が、またそろわなく
なっちゃったよ!
ほんとうだね。
ではまた銀原子をそろえよう。
足りない所を増やしていけば、いつか必ずそろうからね。
右側の銀原子の数を2→4にして…。


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
→ +![]()
![]()
![]()
![]()
![]()
![]()
矢印の左側 … 銀原子(![]()
![]()
![]()
![]()
矢印の右側 … 銀原子(![]()
![]()
![]()
![]()
となって。銀原子も酸素原子も左右で数がそろったね☆だから


この化学反応式で完成だよ!
例題③ 酸化銀を加熱して、銀と酸素に分かれる化学反応式を書け。
答え 2Ag2O → 4Ag + O2
だね!
さて、これで化学反応式のつくり方の説明は終わりだよ。
よくがんばったね!
ただ、1回読んだだけでは理解が難しいから、1章から何度もくり返して読むんだよ。
そして、原子の記号や化学式も練習問題で何度もチャレンジしてね。
それじゃあ、またね☆
化学反応式の書き方をもう一度確認したければ
下のリンクを使ってね!
その他の学習ページは下から
さわにいは、登録者10万人の教育YouTuberです。
中学の成績を上げたい人は、ぜひYouTubeも見てみてね!
また、さわにいと理科の成績を上げる塾「さわにい理科塾」もやってます!
他のページも見たい人はトップページへどうぞ。



またねー!












コメント