このページは「中和」について中学生向けに詳しく解説をします。
- 中和とは何か
- 中和がおこるしくみ
を知りたい人はこのページを見ればバッチリです!
 ねこ吉
ねこ吉よろしくお願いします!
うん。よろしくね。
それでは解説スタートです。
(動画で学習したい人は↓)
中和とは
まずは中和とは何かを説明するね。中和とは「酸とアルカリが互いの性質を打ち消し合う反応」のことだよ。
- 中和とは
- 酸とアルカリが互いの性質を打ち消し合う反応。
中和が起こると水が生じる。



酸とアルカリって、何だっけ?
酸とは水に溶けると酸性になる物質のことだよ。
酸性の溶液は水素イオン(H+)を含んでいるんだ。
酸性の溶液の特徴は
- 青色のリトマス紙を赤色に変える
- BTB溶液を黄色に変える
- 鉄・マグネシウム・亜鉛あえんなどの金属を加えると水素が発生する
- なめると酸っぱい
だったね。
反対にアルカリとは水に溶けるとアルカリ性になる物質のことだよ。
アルカリ性の溶液は水酸化物イオン(OH−)を含んでいるんだ。
アルカリ性の溶液の特徴は
- 赤色のリトマス紙を青色に変える
- BTB溶液を青色に変える
- フェノールフタレイン液を赤色に変える
- なめると苦い
などがあるよ。
アルカリとは水酸化物イオン(OH−)をふくむ溶液のことだったね。


酸性の溶液に含まれる水素イオンと、アルカリ性の溶液に含まれる水酸化物イオンが合わさると、中和がおきて互いの性質を打ち消し、水が発生するんだね。
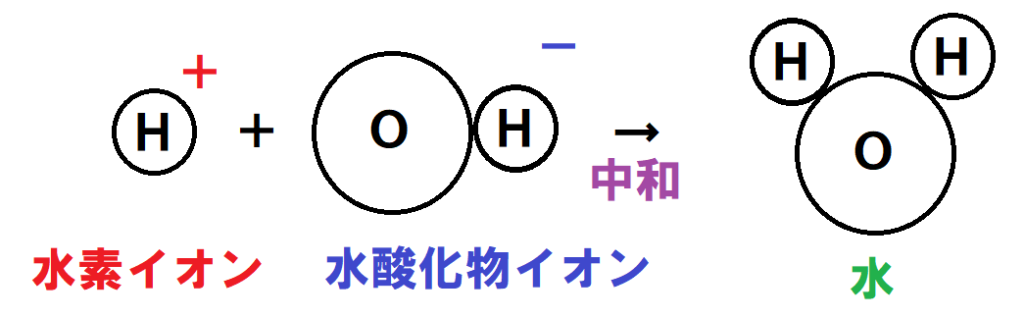

反応式にすると次の通りだね。
H+ + OH− → H2O



水素イオンと水酸化物イオンが性質を打ち消しあい、水ができるのが中和なんだね!
うん。しっかりと確認しておこう。
塩とは
続いては塩について学習していこう。



塩?塩じゃなくて?
うん。読み方を間違えないように注意してね。
塩とは簡単に言うと、「中和した時にできる、水以外の物質」のことだよ!
「塩酸と水酸化ナトリウムの中和」を例に解説するね。
下の図を見てみよう。
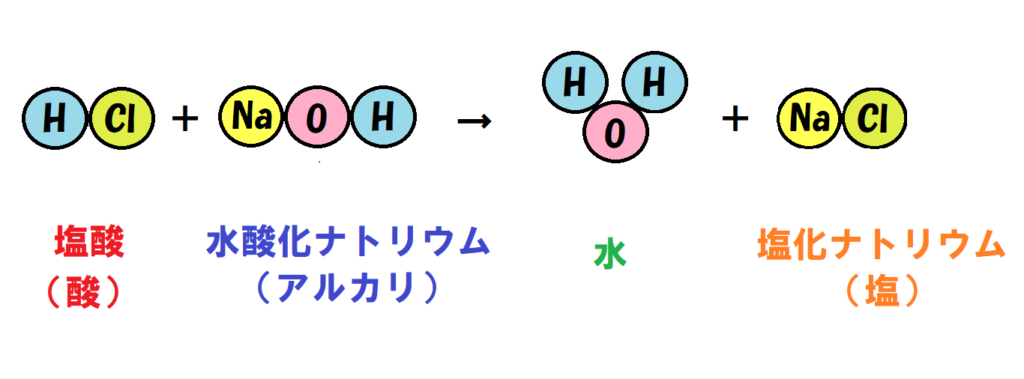

塩酸と水酸化ナトリウムが中和して、水ができているね。



うんうん。
だけどこの反応では、水以外にもう一つ「塩化ナトリウム」という物質ができているよね。



ほんとだね。
このような「中和でできる水以外の物質」のことを塩というんだよ。
- 塩とは
- 中和でできる水以外の物質
教科書では塩のことを
酸の陰イオンとアルカリの陽イオンが結びついてできた物質のこと
と表現するよ。少し難しい言い方だけど「中和でできる水以外の物質」と同じ意味だね。
ちなみに、今回できた「塩化ナトリウム」は「食塩」のことだよ。
おにぎりなどにかけて食べるよね。



食べられる塩だから「食塩」というんだね。
中和の例
それでは、テストによく出る中和の例を説明していくね。
- 塩酸と水酸化ナトリウムの中和
- 硫酸と水酸化バリウムの中和
- 塩酸と水酸化カルシウムの中和
の順で解説するよ。
塩酸と水酸化ナトリウム水溶液の中和
まずは塩酸と水酸化ナトリウムの中和だよ。



さっきも出てきたね。
うん。塩酸と水酸化ナトリウムの中和は下のようになるよ。
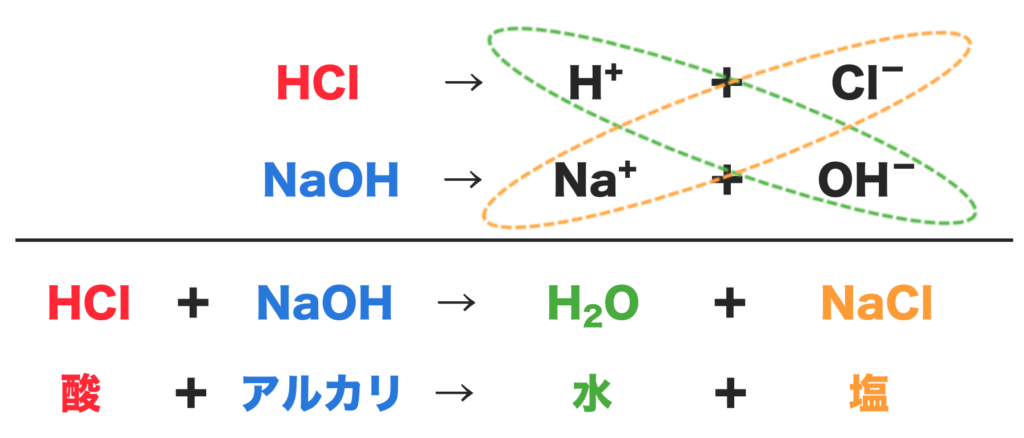

まず、塩酸(HCl)は水素イオン(H+)と塩化物イオン(Cl−)に電離するよね。
- 電離とは
- 物質が陽イオンと陰イオンに分かれること
そして水酸化ナトリウム(NaOH)は、ナトリウムイオン(Na+)と水酸化物イオン(OH−)に電離する。
水素イオン(H+)と水酸化物イオン(OH−)が合わさり水(H2O)ができる。
また、ナトリウムイオン(Na+)と塩化物イオン(Cl−)が合わさり、塩化ナトリウムという塩ができるんだね。
これが塩酸と水酸化ナトリウムの中和だよ!
硫酸と水酸化バリウム水溶液の中和
続いてはは硫酸と水酸化バリウムの中和だよ。



何だか難しそう…。
考え方はさっきと同じだよ。硫酸が酸。水酸化バリウムがアルカリだね。
硫酸と水酸化バリウムの中和は下のようになるよ。
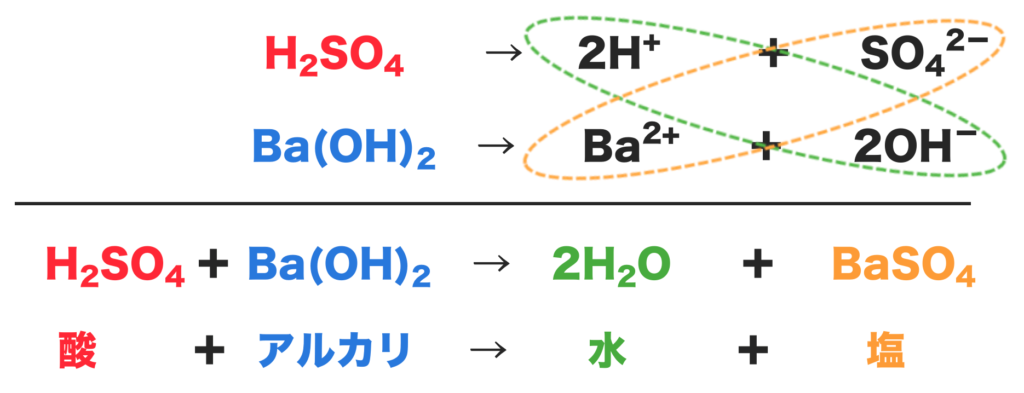

まず、硫酸(H2SO4)は水素イオン(H+)と硫酸イオン(SO42−)に電離するよね。
- 電離とは
- 物質が陽イオンと陰イオンに分かれること
そして水酸化バリウム(Ba (OH)2)は、バリウムイオン(Ba2+)と水酸化物イオン(OH−)に電離する。
水素イオン(H+)と水酸化物イオン(OH−)が合わさり水(H2O)ができる。
また、バリウムイオン(Ba2+)と硫酸イオン(SO42−)が合わさり、硫酸バリウムという塩ができるんだね。
これが硫酸と水酸化バリウムの中和だよ!
塩酸と水酸化カルシウム水溶液の中和
最後は塩酸と水酸化カルシウムの中和だよ。
塩酸と水酸化カルシウムの中和は下のようになるよ。
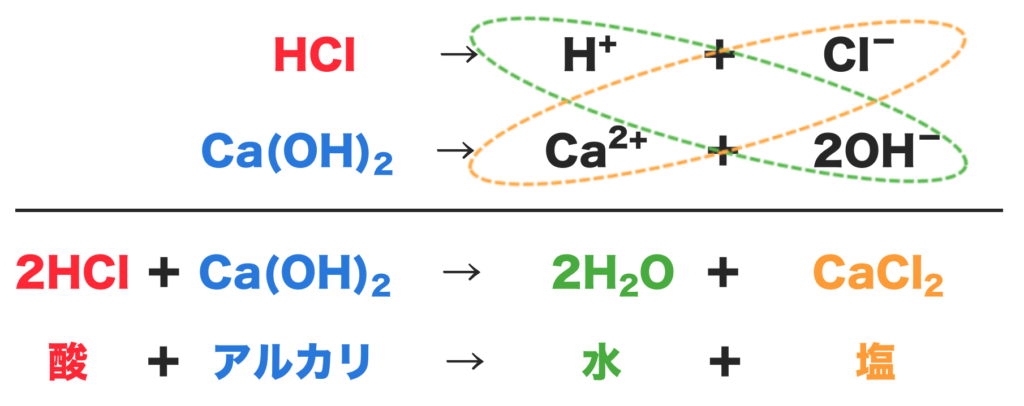

まず、塩酸(HCl)は水素イオン(H+)と塩化物イオン(Cl−)に電離するよね。
そして水酸化カルシウム(Ca(OH)2)は、カルシウムイオン(Ca2+)と水酸化物イオン(OH−)に電離する。
水素イオン(H+)と水酸化物イオン(OH−)が合わさり水(H2O)ができる。
また、カルシウムイオン(Ca2+)と塩化物イオン(Cl−)が合わさり、塩化カルシウムという塩ができるんだね。
これが塩酸と水酸化カルシウムの中和だよ!



中和をすると必ず水ができるね。
だけど塩はそれぞれ異なる物質になるんだね。
そういうことだね。大切なことなので、しっかりと確認しておこう!
重要
中和が起きると必ず水ができる。
塩は中和ごとに異なる物質ができる。
塩酸と水酸化ナトリウムの中和の実験
続いては、テストで最も出題される、塩酸と水酸化ナトリウムの中和の実験を詳しく解説するよ。
ビーカー中のイオンの変化
まずは塩酸を用意しよう。
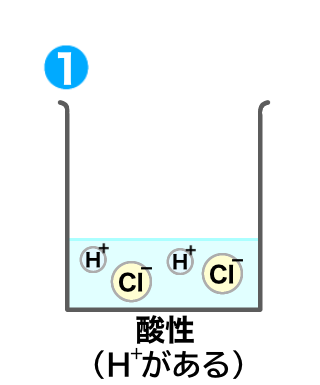

塩酸は当然酸性だね。



水素イオン(H+)を含むもんね。
ではこの塩酸に、アルカリ性の水酸化ナトリウム水溶液を入れてみよう。(OH−を含むからアルカリ性なんだね。)
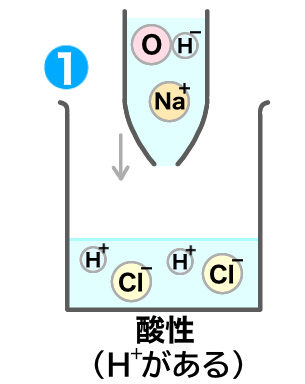

すると中和が起き、下の図のようになるよ。
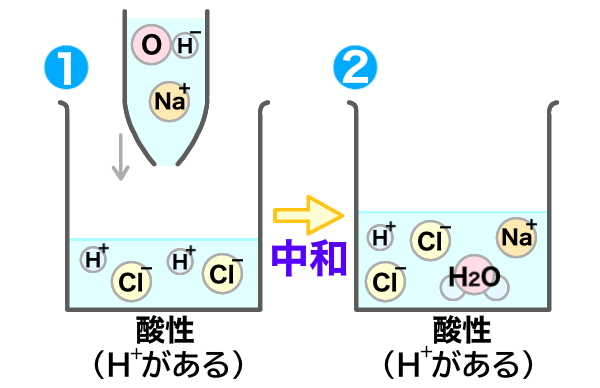




中和がおきて、水ができたね!
うん。中和が起きたけど、まだ水素イオン(H+があるから酸性だね!)
さらに水酸化ナトリウム水溶液を加えてみよう。
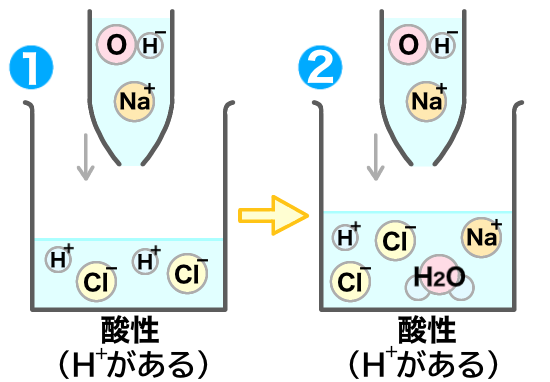

するとさらに中和が起きるよ。

中和が起きて、水が発生したね。
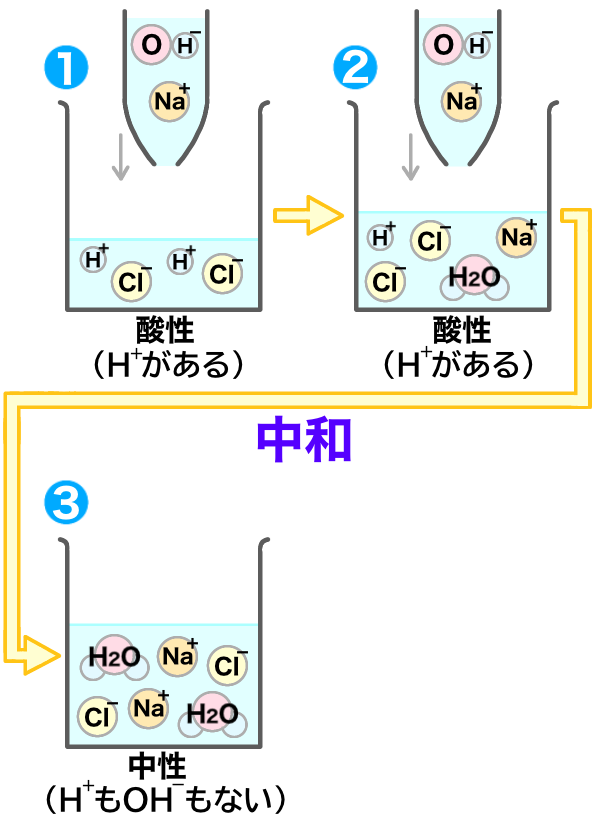
ここで、水素イオンが溶液中から無くなったね!つまり③の溶液は、中性になっているんだね!
これはとても大切なポイントだよ!
ではさらに、水酸化ナトリウムを加えてみよう!
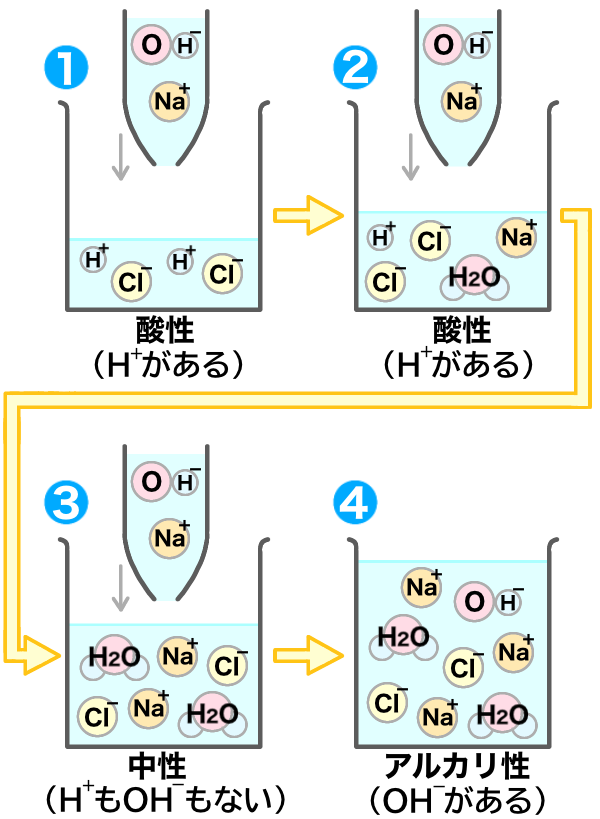

すると今度は、水素イオンが無いから、中和がおきないね!



水素イオンと水酸化物イオンが合わさるのが中和だから、水素イオンが無いと中和が起こらないんだね!
うん。そういうこと!
中和がおこらず、水酸化物イオンが加わったから、アルカリ性になったんだね!
この実験の流れはとても大切だから、必ず覚えておこうね!
イオンの変化をグラフで表すと
続いて、この実験のイオンの変化をグラフで表してみよう。
- 水素イオンの変化
- 水酸化物イオンの変化
- ナトリウムイオンの変化
- 塩化物イオンの変化
をそれぞれ詳しく見ていこう。
水素イオンの数の変化


この実験の①〜④までの変化で、水素イオンの変化は次のグラフのように表すことができるよ。
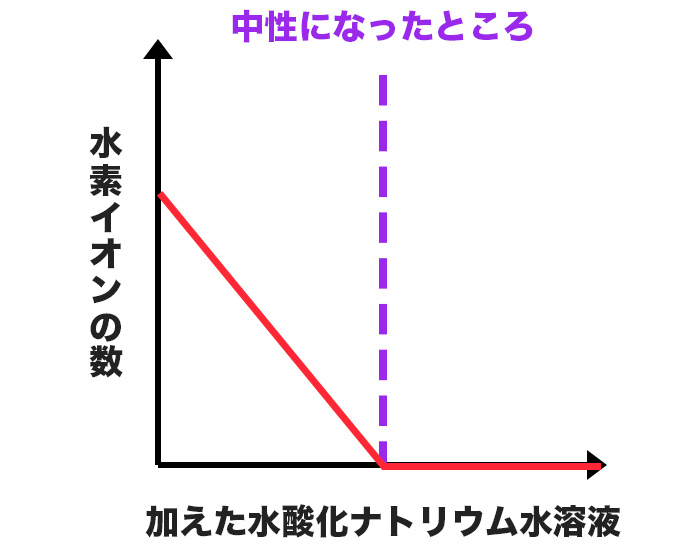

水素イオンは、初めから塩酸の中に入っているけれど、水酸化ナトリウムが加わるたびに中和されて少なくなり、ついには無くなってしまうんだね。
水酸化物イオンの変化
水酸化物イオンの数の変化は、次のグラフのようになるよ。
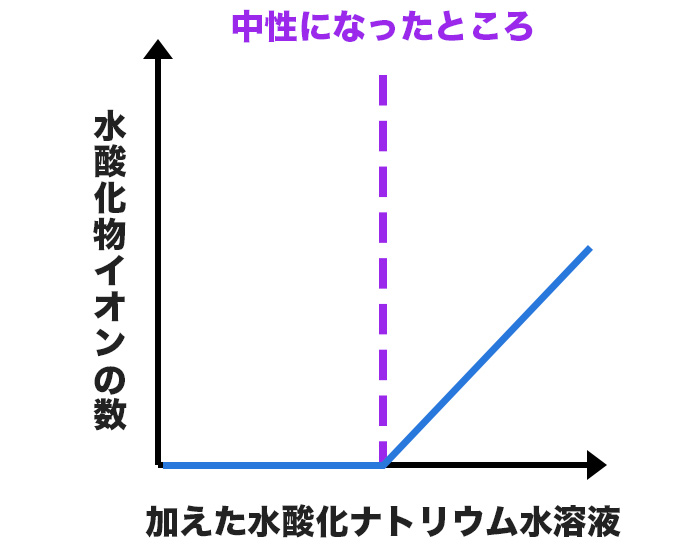

水酸化物イオンは、水酸化ナトリウム水溶液を加えていっても、始めはビーカーの中に増えていかないんだ。
なぜなら水酸化ナトリウム水溶液を加えても、水酸化物イオンは水素イオンと合わさって中和され、無くなってしまうからだね。
そして、水素イオンが無くなり、中性になったところからは、水酸化ナトリウム水溶液を加えるたびに、水酸化物イオンは増えていくんだね!


ナトリウムイオンの変化
ナトリウムイオンは、水酸化ナトリウム水溶液を加えるたびに増えていくよ。上の図をよく見て確認しておこう。
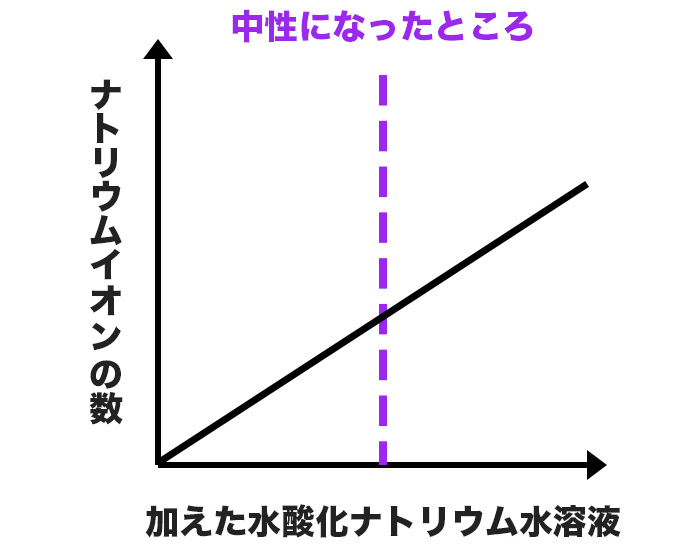

ナトリウムイオンと塩化物イオンは、溶液中では結びつかないから注意してね!
塩化物イオンの変化
塩化物イオンは、始めから塩酸の中に入っているね。
そして、塩化物イオンは、溶液中ではナトリウムイオンと結びつかないから、グラフは下のようになるよ。
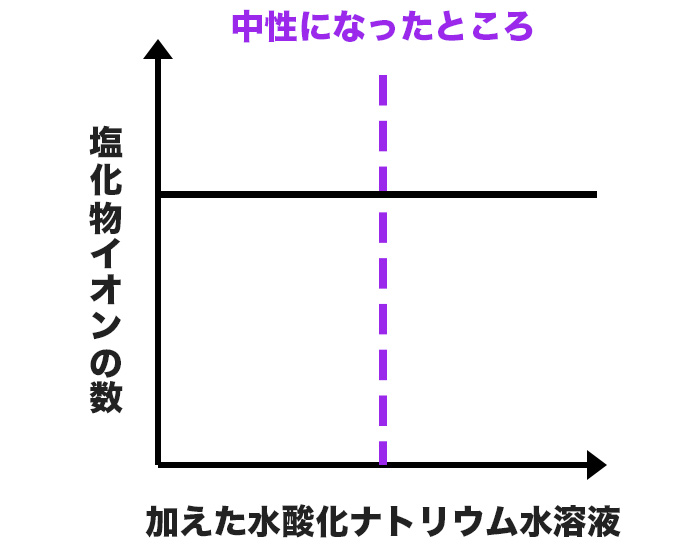




始めから一定で変化しないんだね!
うん。そういうこと。
まとめ
これで中和の解説を終わるよ。
覚えることが多くて大変だったね!
- 中和とは何か
- 塩とは何か
- 中和の実験
これらは必ずしっかりと確認しておこうね!



了解です!













コメント
コメント一覧 (2件)
とてもわかりやすくていつも使ってます。
お役に立ててよかったです!勉強がんばってください!!応援しています!!