塩酸の電気分解の中学生向け解説ページです。
この単元は中学3年生の化学で学習します。
塩酸の電気分解の
- 実験の動画
- 化学反応式
- 実験の解説
を知りたい人は
このページを読めば詳しく学習できるよ☆
まずは時間がない人のために、
化学反応式を先に書いておくね!
2HCl → H2 + Cl2
自己紹介
「さわにい」といいます。元中学理科の教員。
現在は毎月30万人が利用する理科サイトの運営者です。
登録者9万の教育YouTuberでもあります。
さわにいと理科の成績を上げる塾「さわにい理科塾」やってます!
それでは塩酸の電気分解の解説スタート!
塩酸の電気分解の実験動画
塩酸とは、「塩化水素」が水に溶けた溶液だよ。

 ねこ吉
ねこ吉これ、そのまま使うの?
いや、これを水でうすめて使うんだよ。
うすめないと危険だからね!
では、この水溶液に電流を流してみるよ。
陽極(+側)からは塩素が発生し
陰極(-側)からは水素が発生するよ!



すごい!両側から気体が!
うん。
陰極から水素の泡が発生するのが目立つけれど、
陽極から塩素の泡も発生しているのも見逃さないでね!
塩素は黄緑色だから、溶液が少し黄色く色づくね!



ほんとだ!気づかなかった!
これが塩酸の電気分解の実験動画だよ。
ちなみに
水素は
火のついたマッチを近づけると燃える
塩素は
刺激臭(プールの臭い)
殺菌・漂白作用があり、インクの色を消すことができる
という特徴をそれぞれもつよ!
また、実験は
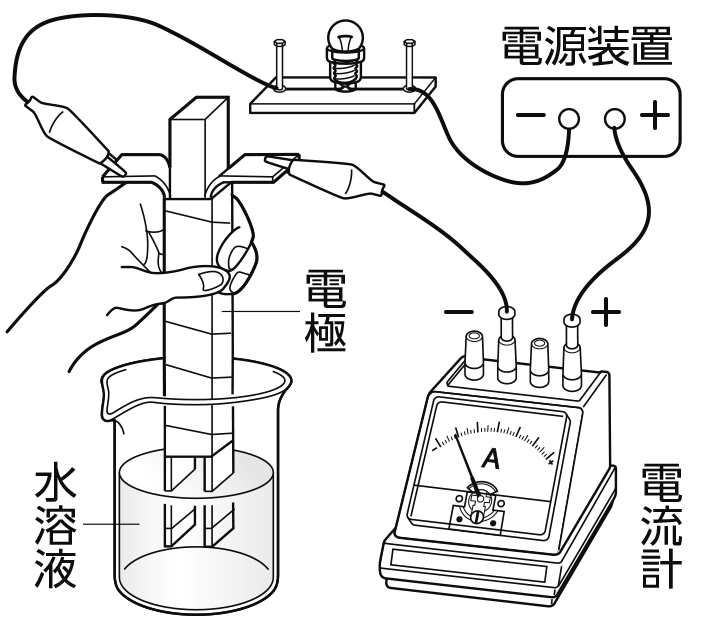

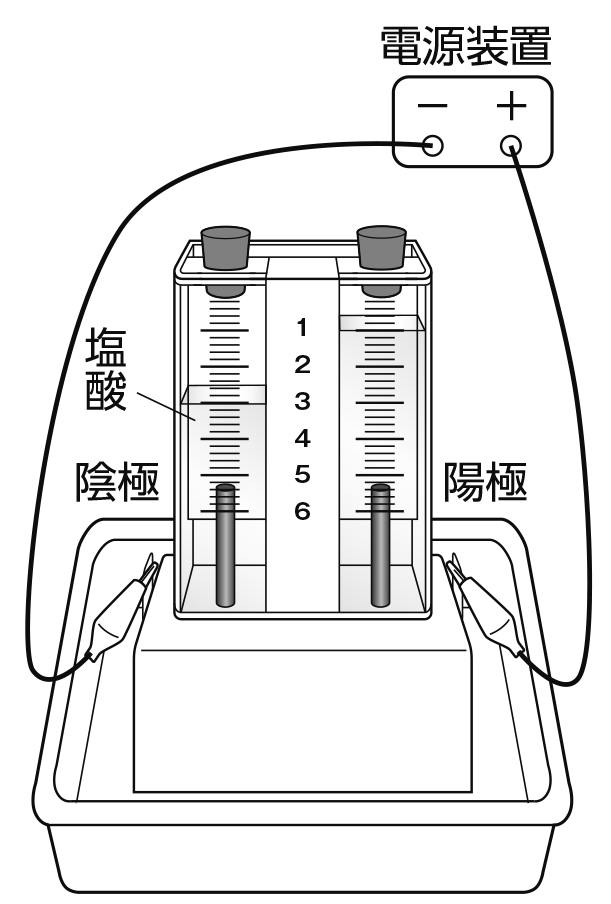

これらのどちらの実験器具でも行うことができるよ。



了解。テストでどちらの図が出ても、陽極→塩素。陰極→水素と答えられるようにするよ!
うん。そうしてね。
では次に、塩酸の電気分解の化学反応式を確認していこう!
塩酸の電気分解の化学反応式を解説するよ。
まず、化学式を一つ一つ確認しよう。
- 塩酸の化学式 → HCl
- 水素の化学式 → H2
- 塩素の化学式 → Cl2
この3つの化学式は、小さい数字


までしっかりと覚えないと意味がないよ!
必ずしっかり覚えよう!



了解☆
次に化学式を一つ一つモデルで見てみよう。
「モデル」とは「分かりやすく書いた絵」のことだよ!
HClのモデル → ![]()
![]()
H2のモデル → ![]()
![]()
Cl2のモデル → ![]()
![]()
このようになるね!
(モデルや化学式を詳しく学習したければ、このページを読んでね!)
では化学反応式を見てみよう。
塩酸が水素と塩素に分解だね!
つまり
塩酸 → 水素 + 塩素
この、漢字を化学式にそれぞれ直すと
HCl → H2 + Cl2
という化学反応式になるね!
(このままでは✖だよ。)
モデルで見てみよう。
![]()
![]()
![]()
![]()
![]()
![]()
となるね。これは
矢印の左と右で、原子の個数が合っていないね!
(矢印の左:水素一個塩素一個。矢印の右:水素二個塩素二個)
つまり、係数をつけて、原子の数を合わせないといけないね!
係数とは、下のピンクの下につける数字のことだよ。





今回は、矢印の左と右で原子の個数が違うから、ここに数字をつけて数を合わせないといけないんだね!
うん。そういうこと!
では係数をつけて、原子の数を合わせよう。
原子の数が足りないところを増やしていけば、必ず数が合うよ!
左側の個数が少ないから、左に係数をつけて


こうなるね。
(数合わせの時はピンクの□の中にしか数字を付けてはいけないよ!)
2HCl → H2 + Cl2
これをモデルで見てみよう。
矢印の左:![]()
![]()
![]()
![]()
矢印の右:![]()
![]()
![]()
![]()
どちらも、水素原子2個、塩素原子2個で、原子の数が矢印の左右でそろったね!
だから、塩酸の電気分解の化学反応式は
2HCl → H2 + Cl2
になるんだね!
塩酸の電離とイオン
(おまけ)
塩酸の電気分解を、
イオンを使って簡単に説明しておくね。



イオンって何だっけ…?
イオンとは「原子が+か-の電気を帯びた(持った)もの」だね!
気体の塩化水素(HCl)は、
まだイオンに分かれて無いけれど、
これを水に溶かすと、
- 水素のイオン(水素イオン)と
- 塩素のイオン(塩化物イオン)
に分かれるんだ。
(これを「電離」と言うよ!)


電離式は下のようになるよ。
HCl → H+ + Cl–
電離した塩酸をモデルで書くと下のようになるね。
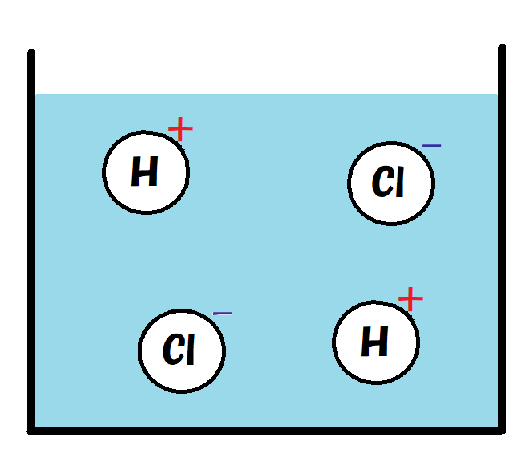

これに電流を流すと、
塩化物イオンは陽極に引かれ、
水素イオンは陰極に引かれるよ。
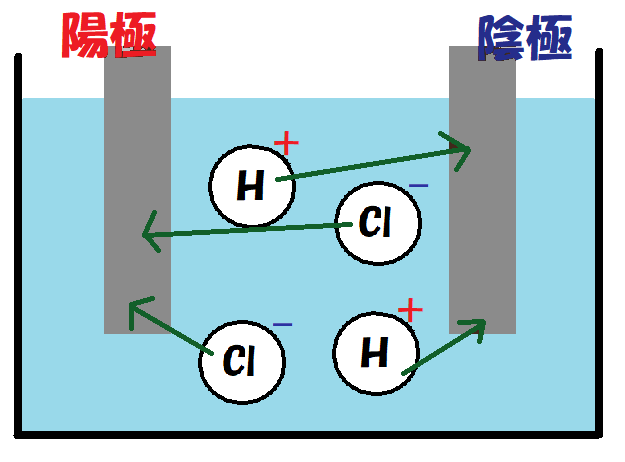

そして、
塩化物イオンは陽極に電子を渡して
塩化物イオン → 塩素(と渡した電子2個)
2Cl– → Cl2 + 電子2個
となり、
水素イオンは陰極から電子を受け取り
水素イオン(と受け取った電子2個) → 水素
2H+ + 電子2個 → H2
となるんだね。
少し難しいけれど、
イオンで電気分解を理解できると、完璧だよ☆
これで、塩酸の電気分解の解説を終わるね!
さわにいは、登録者9万人の教育YouTuberです。
中学の成績を上げたい人は、ぜひYouTubeも見てみてね!
また、さわにいと理科の成績を上げる塾「さわにい理科塾」もやってます!
他のページも見たい人はトップページへどうぞ。



またねー












コメント
コメント一覧 (3件)
コメントで質問させていただきます。
塩酸ではないのですが塩水を電気分解したらなんか緑色の藻、見たいのが出てきて気持ち悪くなりました・・・・
どうしてそうなったのですか、あと藻みたいなものは何ですか?
こんにちは!
コメントありがとうございます!
粒の形!なるほどです。
検討させていただきますね
こんにちは返信遅れて申し訳ありませんでした。
あの後勉強とかいろいろしておそらくですが電極を鉄製のもので電気分解をしていたためイオンがだだもれになってそれが塩素と反応、青や緑の物質が沈殿していったのではという考えにまとまりました、そのあとの電極は細くなっていたので何かあって溶けたのかな?みたいなこと思ったのですが多分イオン漏れによって減ったんだと思います(笑)いろいろと考えていただきありがとうございました。