このページでは中学生向けに中学3年生で学習する「イオン」について解説をしていきます。
- イオンとは何?
- 陽イオンのでき方は?
- 陰イオンのでき方は?
これらを知りたい人は、このページを見ればバッチリ理解することができますよ。
 ねこ吉
ねこ吉解説よろしくお願いします!
うん。よろしくね。
それでは、解説スタートです。(動画で学習したい人は↓)
イオンとは何か
まずは「イオンとは何か」の解説からはじめるよ。
ねこ吉。イオンとは何かわかるかな?



聞いたことはあるけど、よくわからないよ…。
そうだよね。まずは「イオンとはどのようなものか」をしっかりと理解しよう。
まずは結論
イオンとは「原子が電気を帯びたもの」だよ。
(帯びるとは、「電気をもったもの」というイメージでOKだよ。)



原子が電気を帯びたもの?
うん。中学2年生で「原子」について学習をしたよね。
「水素原子」「酸素原子」「塩素原子」など、いろいろな種類の原子があったね。






(あまり覚えていない人は、こちらの記事も見てみてね!)
これらの原子が電気を帯びる(もつ)と、それをイオンというんだよ。
例えば
水素原子が+のイオンを帯びる → 水素イオン(H+)
塩素原子が−のイオンを帯びる → 塩化物イオン(Cl−)
という具合だね。
あまり難しく考えずに「原子が電気を帯びたらイオン!」
と簡単に覚えることがポイントだよ!



わかりました!
ポイント
原子が電気を帯びたらイオンになる。
イオンのでき方
では続いて、原子がどのようにイオンを帯びる(もつ)ようになるのかを解説していくよ。
原子の構造(つくり)
原子がどのようにイオンになるかを知るためには、原子の構造を知る必要があるよ。
ここでは例として、ヘリウム原子を見てみよう。





この原子を詳しく見てみるんだね。
うん。そういうことだね。ヘリウム原子の構造は、下のようになっているんだよ。
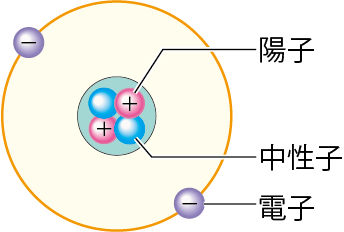

ヘリウム原子(他の原子も)は
- 陽子
- 中性子
- 電子
という3つからできているんだね!
ポイント
原子は「陽子」「中性子」「電子」からできている。
(ただし水素原子は中性子が無いこともある)
また、原子の種類は「陽子の数」によって決まるんだよ。
下の図を見てみよう。これは「周期表」と呼ばれるものだよ。


原子の記号の上に数字が書いてあるね。
原子のNo.1、水素は陽子が1つ。No.2のヘリウムは陽子が2つ。No.3のリチウムは陽子が3つ。という感じだよ。



酸素はNo.8だから、陽子が8つなんだね。
うん。そういうこと!
陽子・中性子・電子とは
次に「陽子」「中性子」「電子」の性質を詳しく解説するよ。
陽子


陽子は原子の中心にある、+の電気をもった粒のことだよ。
陽子が+の電気をもっていることは、とても重要だよ!
中性子


中性子も原子の中心にある粒のことだよ。
中性子は+の電気も−の電気ももたないことに注目をしておこう。
また、陽子と中性子を合わせた、原子の中心となるものを「原子核」というよ。
この言葉も必ず覚えておこう。
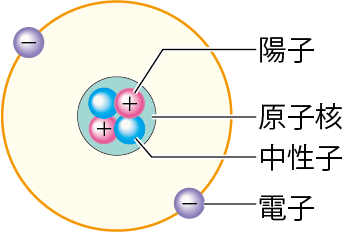

陽子と中性子を合わせて、原子核という!
そして、基本的には陽子と中性子は結びついているから、「簡単に飛んでいくことは少ない。」ということも理解をしておこう。
電子
最後は「電子」だね。


電子は原子核のまわりをまわっている粒なんだ。
陽子と反対で、−の電気をもっていることが特徴だよ。
ポイント
電子は−の電気をもっている
また、電子は陽子・中性子と違い、他のところへ飛んでいってしまったり、反対に他のところから入り込んでくることがあるんだ。
原子核のまわりを飛んでいるので、原子や中性子と異なり不安定なんだね。
ポイント
電子が飛んでいったり、入り込んできやすいことも、イオンを考える上で大切なポイントだから確認しておこう!
陽イオンのでき方
では、陽イオンのでき方を考えていこう。陽イオンとは+の電気を帯びたイオンのことだよ。
ねこ吉、原子はどのような粒からできていたか覚えてる?



陽子・中性子・電子でしょ。
大正解。そしてその3つの粒の中で、出入りをしやすいのはどれだったかな?



「電子」だよ。外をまわっているから、飛んでいったり、入ってきたりしやすいんだよね。
素晴らしい。その通り!
つまりイオンは、原子の中の「電子」が出入りすることでつくられるんだ。
ポイント
イオンは電子が出入りすることでつくられる。
では、陽イオンのでき方を詳しく見ていこう。
今回はナトリウムイオンを例に見ていくよ。
(ナトリウムは、陽イオンになりやすい代表的な原子だよ。)
下の図がナトリウム原子。


このナトリウム原子が、電子を失うと「ナトリウムイオン」という陽イオンになるんだ。


Na+というのがナトリウムイオンだね。



どうして電子を失うとプラスのイオンになるの?
ナトリウム原子は「陽子を11個」「電子を11個」もつ原子なんだ。
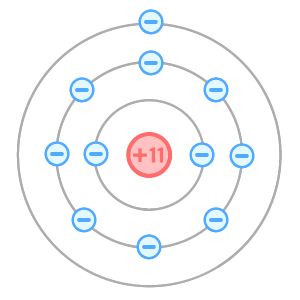

この時点では、プラスとマイナスの個数が同じだね。(これを電気的に中性)というよ。
だけどさっきの図のように、電子が1個飛んでいってしまうとどうだろう。


今度は「陽子が11個」「電子が10個」となってしまうね。



電子が1個飛んでいったからだね。
その通り。つまり+の電気をもつ陽子が11個。−の電気をもつ電子が10個になるね。
プラスが1つ多いから、ナトリウムイオンはNa+となるんだね。
このように、プラスが1つ多いイオンを「一価の陽イオン」というよ。
ナトリウム原子は普通、「一価の陽イオン」にしかならないよ。
Na2+という二価の陽イオンや
Na−という一価の陰イオンにはならないと覚えておこう。
この変化を式で表すと下のようになるよ。
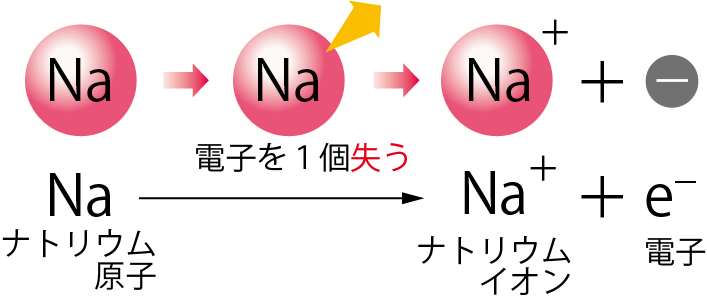

e−とは電子のことだよ。



ナトリウム原子が、ナトリウムイオンと電子に分かれたってことだね。
うん。そういうことだね。これで陽イオンのでき方の解説を終わるよ。
いろいろな種類の陽イオンは、このページの最後にまとめるね。
では続いて、陰イオンのでき方を確認しよう。
陰イオンのでき方
では、陰イオンのでき方を考えていこう。陰イオンとは−の電気を帯びたイオンのことだよ。



陽イオンの反対だね。
その通り、陽イオンは「原子が電子を失う」ことでつくられるイオンだったね。
陰イオンは反対に、「原子が電子を受けとる」ことでつくられるイオンなんだ。
ポイント
陰イオンは原子が電子を受けとることでつくられる
では、陰イオンのでき方を詳しく見ていこう。
今回は塩化物イオンを例に見ていくよ。
(塩素原子がイオンになったものを「塩化物イオン」というよ。塩素は、陰イオンになりやすい代表的な原子だよ。)
下の図が塩素原子。


この塩素原子が、電子を受けとると「塩化物イオン」という陰イオンになるんだ。


Cl−というのが塩化物イオンだね。



どうして電子を受けとるとマイナスのイオンになるの?
塩素原子は「陽子を17個」「電子を17個」もつ原子なんだ。
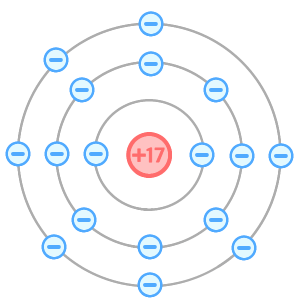

この時点では、プラスとマイナスの個数が同じだね。(これを電気的に中性)というよ。
だけどさっきの図のように、電子を1個受けとるとどうだろう。


今度は「陽子が17個」「電子が18個」となってしまうね。



電子を1個受け取ったからだね。
その通り。つまり+の電気をもつ陽子が17個。−の電気をもつ電子が18個になるね。
マイナスが1つ多いから、塩化物イオンはCl−となるんだね。
このように、マイナスが1つ多いイオンを「一価の陰イオン」というよ。
塩素原子は普通、「一価の陰イオン」にしかならないよ。
Cl2−という二価の陰イオンや
Cl+という一価の陽イオンにはならないと覚えておこう。
この変化を式で表すと下のようになるよ。


e−とは電子を表す記号だったね。



塩素原子が電子を受けとり、塩化物イオンになったんだね。
うん。そういうことだね。これで陰イオンのでき方の解説を終わるよ。
では最後に、重要な陽イオンと陰イオンをまとめよう!
中学生が覚えるべきイオンのまとめ
陽イオン
赤字は特に重要なもの
| 水素イオン | ナトリウムイオン | カリウムイオン | 銀イオン |
| H⁺ | Na⁺ | K⁺ | Ag⁺ |
| アンモニウムイオン | 銅イオン | カルシウムイオン | 亜鉛イオン |
| NH₄⁺ | Cu²⁺ | Ca²⁺ | Zn²⁺ |
| バリウムイオン | マグネシウムイオン | 鉛イオン | ニッケルイオン |
| Ba²⁺ | Mg²⁺ | Pb²⁺ | Ni²⁺ |
| コバルトイオン | マンガンイオン | 鉄イオン | アルミニウムイオン |
| Co²⁺ | Mn²⁺ | Fe²⁺ | Al³⁺ |
陰イオン
赤字は特に重要なもの
| 塩化物イオン | ヨウ化物イオン | 硫化物イオン | 水酸化物イオン |
| Cl⁻ | I⁻ | S²⁻ | OH⁻ |
| 硝酸イオン | 硫酸イオン | 炭酸イオン | 酢酸イオン |
| NO₃⁻ | SO₄²⁻ | CO₃²⁻ | CH₃COO⁻ |
これで中学生のイオンに関する解説を終わるよ。
イオン式をしっかりと覚えたい人はこちらのページを見てみてね!



練習問題もできるよ!














コメント
コメント一覧 (12件)
学校の先生の解説だとよく分からなかったけど、このサイトの解説で矜羯羅がっていた頭が整理されてよ〜く分かりました!どうもありがとうございました
お役に立ててよかったです!
これからも応援しています!
なるほど!高校受験の参考にします!
学校の教科書を丸暗記するか悩んでいたので、とっても助かりました。ありがとうございます
お役に立ててよかったです!
応援しています!!
わかりやすいです
お役に立ててよかったです!
とてもよく理解できました。
簡単にまとめられていて単純に理解しやすかったです。
一点誤植
陰イオンの出き方のところで↓
Cl−というのがナトリウムイオンだね。
とありました。
お役に立てたようで嬉しいです。
ご指摘ありがとうございます。
修正させていただきました。
今後ともご指導ご鞭撻のほどよろしくお願いいたします。
とても、分かりやすかったです!
化学電池の解説ページもあると嬉しいです✨
(特にボルタ電池・ダニエル電池のところがよく分からないです。)
コメントありがとうございます。
要望に沿って、ダニエル電池のページを作成しました。
よろしければ参考にしてください。
https://sawanii.ne.jp/daniel-batteries/
ありがとうございます!
分かりやすかったです
お役に立ててよかったです!