このページでは、中学3年生で学習するボルタ電池と分極について、中学生向けに解説をしていくよ。

ボルタ電池は最も基本的な電池だけど、慣れないと仕組みが難しく感じるね。
このページを読めば、バッチリ理解できるようになるよ!
 ねこ吉
ねこ吉よろしくお願いします!
それでは解説をはじめます。
(動画で学習したい人は↓)
ボルタ電池とは
ボルタ電池はボルタさんが作った電池だよ。


ボルタ電池の作り方は簡単。
うすい硫酸(H2SO4)に金属の亜鉛板(Zn)と銅板(Cu)をつけ、銅線でつなぐだけでいいんだ!





これだけで電流が流れるの?不思議だね!
ほんとだね。基礎的な電池なら、こんなに簡単に作ることができるんだね!
(硫酸がない場合は、半分に切ったレモンなどに亜鉛板と銅板をつけてもいいんだよ!)
ボルタ電池で電圧が発生するしくみ
では、ボルタ電池でなぜ電圧が発生するのかを考えていこう。
ボルタ電池を理解するためには、イオン化傾向を知ることが大切なんだ。



イオン化傾向?
その通り、イオン化傾向とは、金属がどのくらい陽イオンになりやすいのかを表したものだよ。
下の図を見るとわかりやすいよ。(「イオンになる」とは「金属が溶液に溶ける」と考えていいよ。)
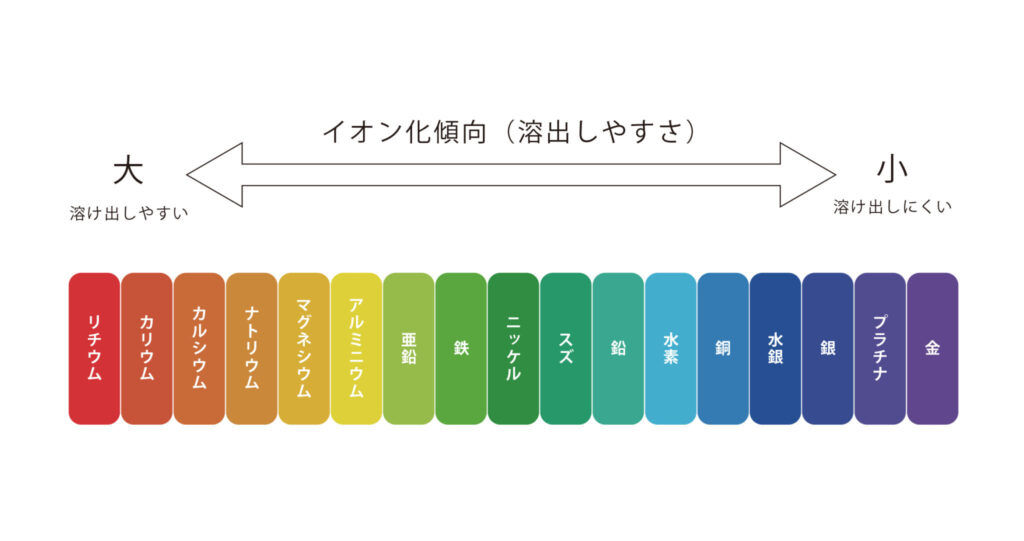

さて、上の図の亜鉛、水素、銅を比べてみよう。
すると、イオン化傾向の大きさは亜鉛>水素>銅となっているね。
イオン化傾向の大きさ
亜鉛>水素>銅
ここでボルタ電池の図を見てみよう。


ボルタ電池では、亜鉛と銅が金属、硫酸に含まれる水素イオンがイオンになっているね。
さて、どんなことが起こると思う?



亜鉛が水素よりイオンになりやすいから、亜鉛がイオンになって、水素イオンがイオンではなくなるのかな?
その通り。素晴らしい!
まず、亜鉛(板)がイオンになるようすを見てみよう。
(亜鉛のイオンはZn2+だったね。数字を含めて必ず暗記しておこう)
下の図のようになるね。


つまり、亜鉛板では、以下のような変化が起こるね。
Zn → Zn2+ + 2e–
「e–」とは電子のこと、つまり、亜鉛が、亜鉛イオンと電子2個に分かれるんだね。
続いて銅板の方を見てみよう。
こちらでは、水素イオンが水素に変化するよ。
下の図のようになるよ。





なるほど、亜鉛がイオンになるときに放出した電子が、銅板のほうに移動してきて、水素イオンが受け取るんだね。
そういうこと。水素イオンが電子を受け取り、水素になるんだね!
つまり、銅板で起こる変化は、以下のようになるね。
2H+ + 2e– → H2
つまり銅板からは、水素イオンが電子を受け取り、(気体の)水素が発生するんだね。
では、ここまでをまとめよう。
ボルタ電池で電圧が発生する仕組み
亜鉛板では、亜鉛が亜鉛イオンになる。
銅板では、水素イオンが水素になる。
そして、電子が移動することで、電流が発生するんだね。
電子と電流の向きは逆向きだから、必ず覚えておくようにしよう。


分極
ボルタ電池の仕組みはわかったかな?



こんなに簡単に電池が作れるなんて、驚いたよ。
ほんとだね。
だけどボルタ電池はつくりが簡単ゆえの、デメリットもあるんだ。



ボルタ電池のデメリット?
うん。実はボルタ電池は、使うとすぐに電圧が落ちてしまい、あまり実用的ではないんだ。



すぐに電圧が落ちるなら、なかなか実際には使えないね…。
そうだんだ。電圧が落ちる原因は、分極によるものなんだ。
最後に、分極とは何かを解説するね。難しくないから安心してね。
下の図を見てみよう。
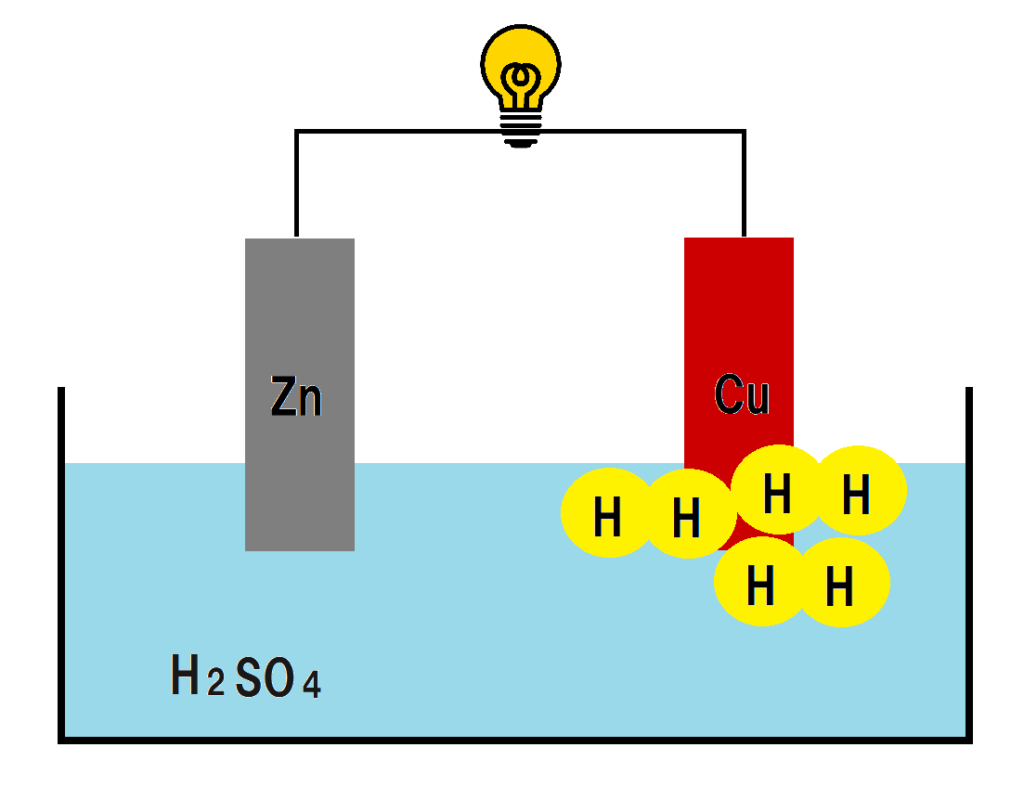

図のように銅板のまわりには、気体の水素が発生しているよね。
このように、水素が銅板のまわりに張り付いてしまうと、水素イオンが電子をもらえず、電流が発生しにくくなってしまうんだ。
これを分極というんだよ。



簡単なつくりの電池だから、欠点もあるんだね。
まとめ
これでボルタ電池に関する解説を終わるよ!
亜鉛、銅、水素の変化と、分極をしっかりと押さえておこうね!
このサイトでは、中学理科に関する情報をまとめているよ。
困ったことがあったら、またいつでも遊びにきてね!



またねー!












コメント