このページでは中学3年生で学習する「ダニエル電池」について解説をするよ!
ダニエル電池は苦手とする中学生が多いところだね。このページを見れば5分でバッチリだよ!
 ねこ吉
ねこ吉お願いします!
それでは解説を始めます。
(動画で学習したい人は↓)
ダニエル電池の歴史と特徴
ダニエル電池は、1836年、イギリスのダニエルが発明した電池だよ。


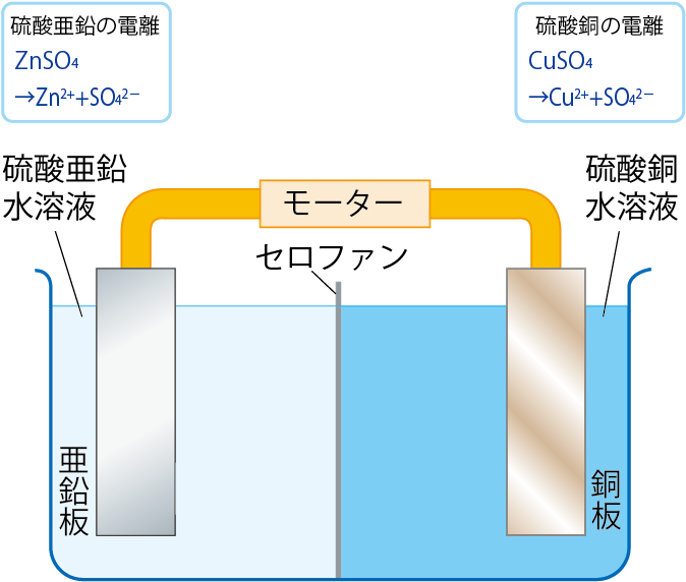
ダニエル電池の特徴は、金属板をつける水溶液を、セロファンなどで分けていること。
これにより、ボルタ電池などと比べて長時間電圧を維持することができるんだよ。

では、ダニエル電池のつくりを詳しく見ていこう。
ダニエル電池のつくり
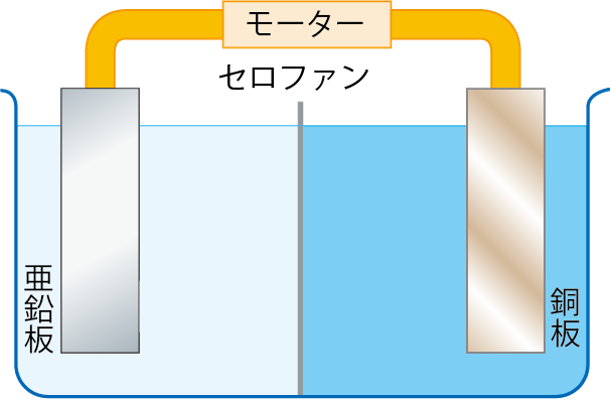
ダニエル電池は亜鉛板を硫酸亜鉛水溶液、銅板を硫酸銅水溶液につけ、これらを導線でつないでいるんだよ。
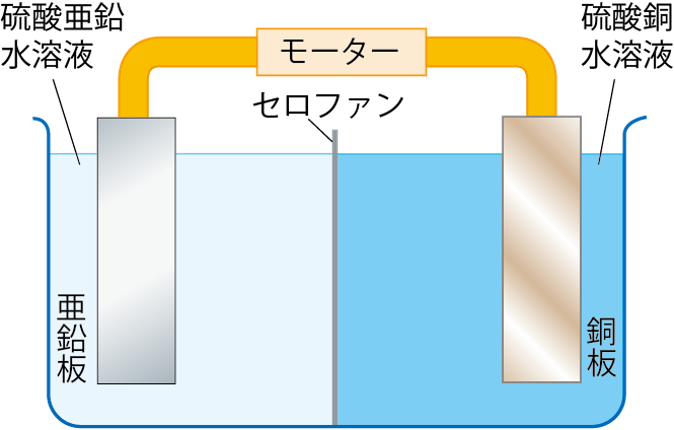

このように接続することで、電圧が発生し、モーターが回ったり、電子オルゴールの音が鳴ったりするんだよ。
つまり電池になるということだね!



これで電池になるなんて、不思議だね。
ほんとだね。
ではなぜ、ダニエル電池をつくると電圧が発生するのか。電池のしくみを詳しく見ていこう。
ダニエル電池とイオン
まず、ダニエル電池の硫酸亜鉛水溶液と、硫酸銅水溶液がどのように電離をしているかを見てみよう。
電離とは
物質が水にとけて 陽イオンと陰イオン に分かれること。


硫酸亜鉛水溶液は
ZnSO4 → Zn2+ + SO42-
のように電離しているよ。
また、硫酸銅は
CuSO4 → Cu2+ + SO42-
のように電離しているよ。



陽イオンと陰イオンに分かれているんだね!
さて、ここで大切になるのがイオン化傾向。
イオン化傾向とは
金属が溶液中で陽イオンになろうとする性質を表したもの
つまり、イオン化傾向が大きいほど陽イオンになりやすいと言えるんだね。
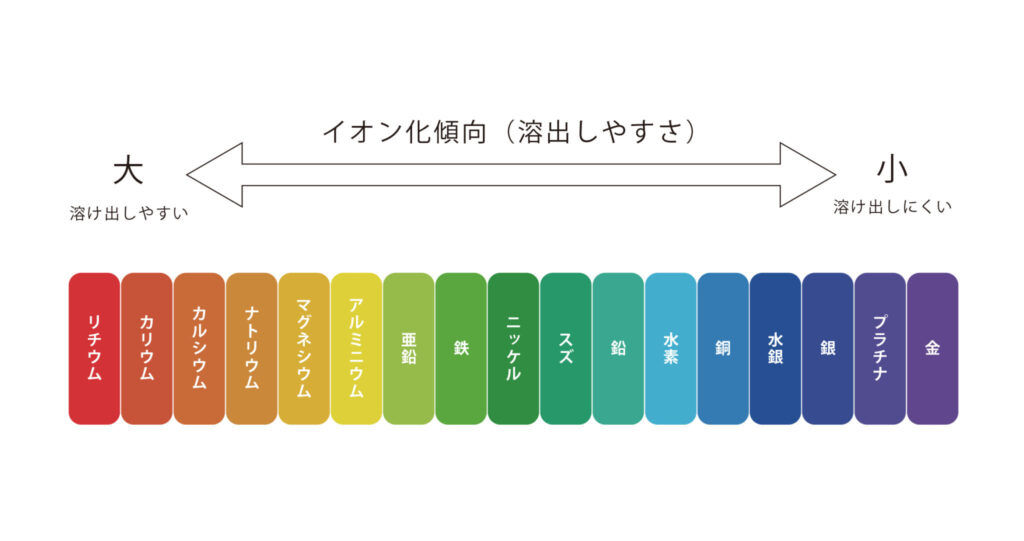

この図の亜鉛と銅を比べると、亜鉛の方が銅よりも陽イオンになりやすいことがわかるね。



確かにそうだね。
だけどダニエル電池の始めの状態では、金属の亜鉛(Zn)と硫酸銅水溶液の中の銅イオン(Cu2+)が存在しているね。
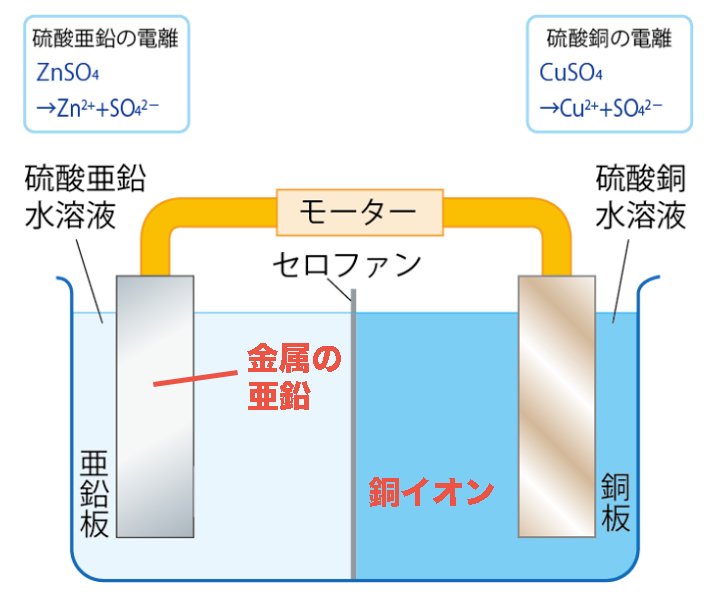




始めの状態では、イオン化傾向の反対だね。
その通り。だから、イオン化傾向に従い、亜鉛が亜鉛イオンへと、銅イオンは銅へと変化していくんだ。
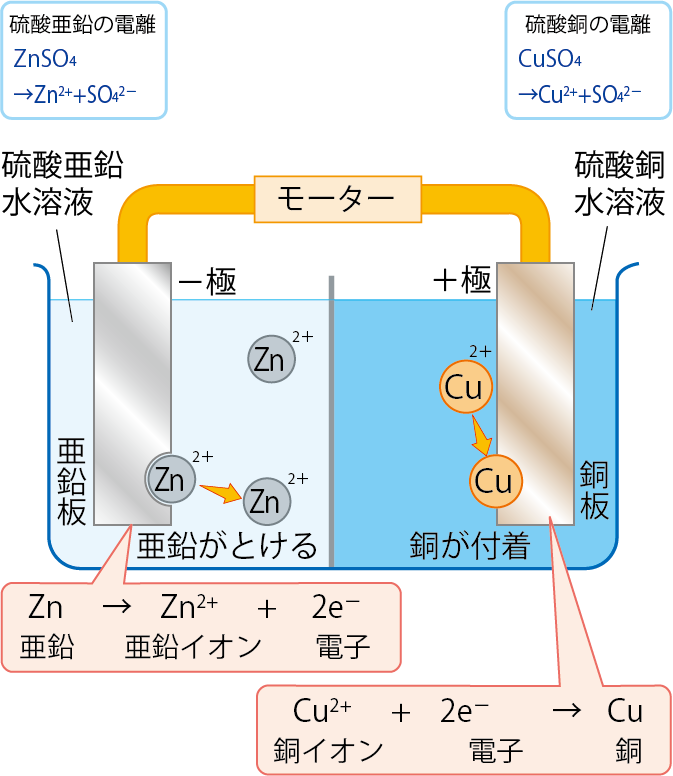




イオン化傾向に従って、亜鉛は亜鉛イオンに、銅イオンは銅になるんだね。
その通り。くり返しになるけど、イオン化傾向(陽イオンのなりやすさ)が亜鉛の方が大きいからだね!
ダニエル電池で電圧が発生する仕組み
亜鉛が亜鉛イオンに、銅イオンが銅になることはわかったかな?
では、なぜこれで電圧が発生し、電池になるのかを考えていこう。
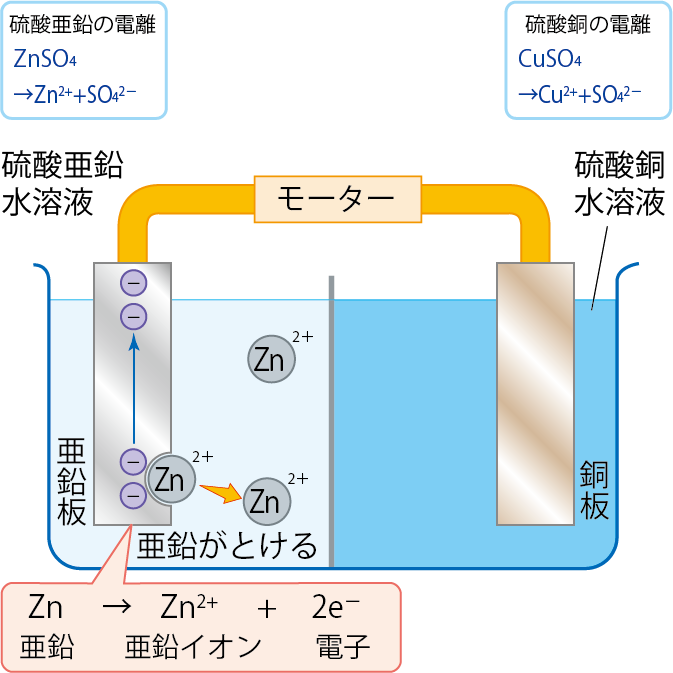
亜鉛が亜鉛イオンになるということは、以下のような変化がおきていると考えられるね。
Zn → Zn2+ + 2e–
e–とは電子のことだよ。
図にすると、以下のようになるね。

また、硫酸銅中の銅イオンは銅にもどるから、以下のような変化になるね。
Cu2+ + 2e– → Cu
図にすると、以下のようになるね。
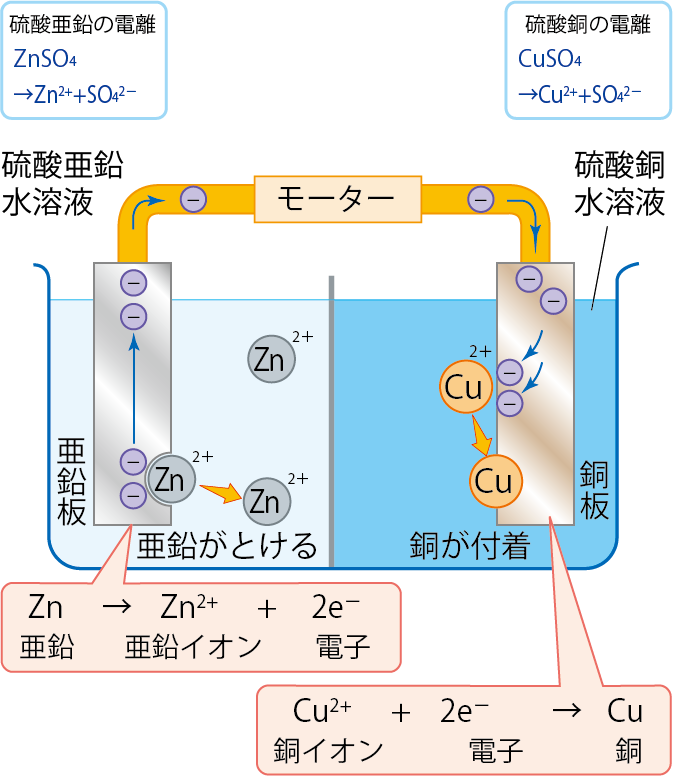

つまり、亜鉛板から銅板へと電子が移動し、電圧が発生することになるんだね。
このとき、電子が移動する向きと、電流の移動する向きは逆になるから注意しよう。
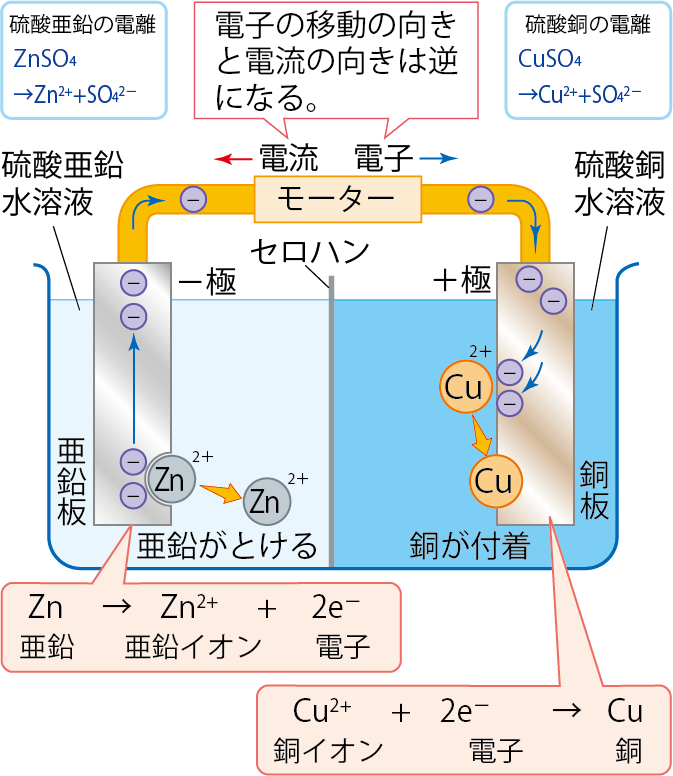

電子の向きと電流の向きは反対になる!
これがダニエル電池で電圧が発生するしくみだよ。わかったかな?



うん!だけど先生、真ん中のセロハンは何のためにあるの?
いい質問だね!
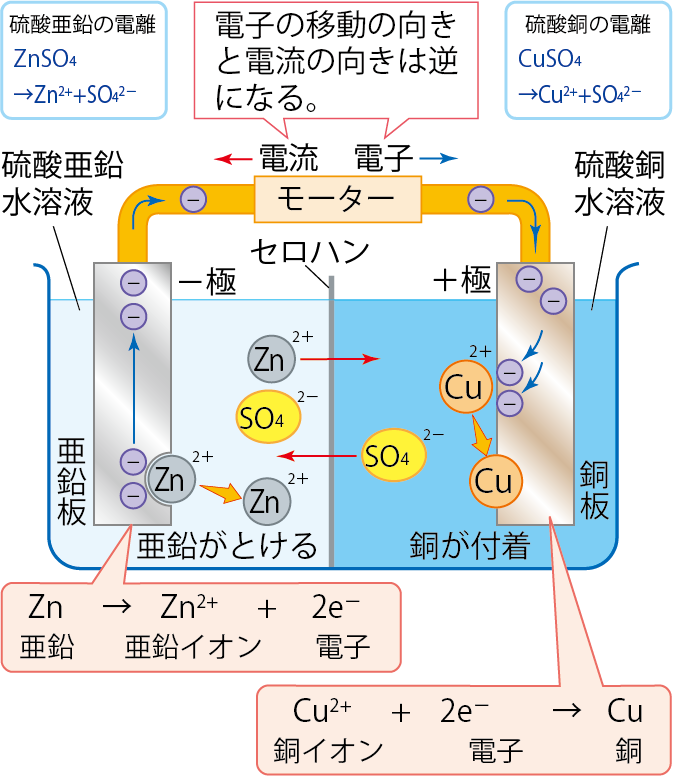
セロハンは、イオンだけを通すはたらきがあるんだ。
もしも硫酸銅と硫酸亜鉛を仕切らず混ぜただけなら、Zn+Cu2+→ Zn2++Cu という変化しか起こらず、本来の目的である電池にはなってくれないよ。
(導線経由ではなく、直接的に電子の授受が行われてしまう)。
だけど完全に仕切ってしまうと、+極側(硫酸銅水溶液)では陽イオン(Cu2+)が析出によってどんどん無くなってしまうね。
一方で、陰イオン(SO42-)はどんどんたまっていき、結果として「導線経由で電子がやってきても、それを受け取る人(陽イオン)が見つからない」という状況になってしまうんだ。
だからセロハンや素焼き板などの「イオンが通れるような小さい穴の開いているもの」を用いて仕切ることで、適度に陰イオンを逃がしつつ、負極側から陽イオンを迎え入れている、という仕組みになっているんだよ。




複雑な理由があるんだね!
そうだね。仕切らない場合でも、完全に仕切ってしまう場合でも、ダニエル電池はうまく機能しないんだ。
セロハンや素焼き板などを上手に使う必要があるんだね!
まとめ
これでダニエル電池に関する解説を終わるよ。
わからないことがあったらコメントで気軽に質問してね!
このサイトでは中学理科の解説をしているよ。またいつでも遊びにきてね!



またねー!












コメント